2017年上半年上海市食品药品监督管理局发布123项医疗器械企业主动召回信息
为加强医疗器械监督管理,控制存在缺陷的医疗器械产品,消除医疗器械安全隐患,保证医疗器械的安全、有效,国家食品药品监督管理总局于2017年1月25日公布了新修订的《医疗器械召回管理办法》(以下简称《办法》)。《办法》中明确了医疗器械生产企业是其生产的医疗器械质量安全的责任主体,应当按照《办法》的规定建立健全医疗器械召回管理制度,收集医疗器械安全相关信息,对可能的缺陷产品进行调查、评估,及时召回缺陷产品。
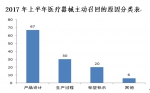
上海市食品药品监督管理局2017年上半年共发布了123项医疗器械企业主动召回信息。按产品种类,有源类产品61项、无源类产品34项、体外诊断试剂产品28项;按产品缺陷严重程度高低,一级召回10项、二级召回59项、三级召回54项。
一、医疗器械企业主动召回原因分析
通过对2017年上半年医疗器械主动召回情况的分析,造成主动召回的原因主要有产品设计缺陷、生产过程控制问题、标签标示错误等几方面原因。产品设计缺陷造成的召回事件约占总数的54%,有源设备类医疗器械由于产品设计缺陷造成的召回事件较多,约占总数的58%,其中有多件由于产品软件缺陷导致的产品故障;生产过程控制问题导致的召回事件约占总数的24%,例如原料存在异常,导致产品存在风险,产品包装袋未密封,导致包装袋无菌屏障破坏等。
二、主动召回事件风险提示
根据2017年上半年医疗器械主动召回情况汇总,提升医疗器械生产经营和使用单位注意相关医疗器械可能存在的风险。
一是关注有源医疗器械的嵌入式软件故障引发的风险。有源医疗器械是相对于无源医疗器械而言的,是指依靠电能或者其他能源,而不是直接由人体或者重力产生的能量,发挥其功能的医疗器械。有源医疗器械的软件组件通过控制或驱动医疗器械硬件发挥医疗用途。2017年上半年医疗器械主动召回事件中,发现部分医疗器械因软件组件故障引起的非预期预警或响应,提示关注有源医疗器械的软件组件故障引发的风险。
二是关注无菌医疗器械因产品密封性破坏引发的风险。无菌医疗器械的包装对维持医疗器械的无菌状态至关重要,通过产品包装形成的无菌屏障系统是医疗器械上市后无菌状态的保证。2017年上半年医疗器械主动召回事件中,发现部分医疗器械因封口等问题造成了无菌屏障系统被破坏。
三是关注标签标识错误可能引发的风险。2017年上半年医疗器械主动召回事件中,发现部分企业存在产品标签缺少生产日期、注册证信息错误、标签误贴为其他产品等情况。
目前,相关医疗器械企业已对可能的缺陷产品进行了调查评估,并采取了相应的纠正预防措施。