药学院李聪课题组发现小胶质细胞表型极化调控新机制
近日,复旦大学药学院李聪教授课题组揭示了活性氧簇在调控小胶质细胞表型极化过程中的关键作用。3月28日,相关研究成果以《定制纳米铈消除活性氧逆转小胶质细胞极化实现神经保护作用》(“Bespoke Ceria Nanoparticles Show a Neuroprotective Effect by Modulating
Phenotypic Polarization of the Microglia”)为题在线发表于《德国应用化学》( Angew. Chem. Int. Ed .)。
调控小胶质细胞表型极化实现神经保护作用
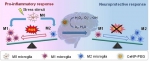
小胶质细胞(Microglia)是脑部驻地免疫细胞,为中枢神经系统最主要的免疫防线。小胶质细胞在生理条件下处于静息态(M0表型),发挥“免疫监视”作用。病理状态下,小胶质细胞迅速激活并伴随转录适应性功能变化。经典激活型(M1极化)小胶质细胞释放促炎因子和毒性物质杀灭病原体。而替代激活型(M2极化)小胶质细胞则通过促进组织修复和再生实现对神经保护的作用。临床研究表明,过度激活的M1表型小胶质细胞会引起神经元失能、损伤和退变,并在脑血管疾病、神经退行性疾病、神经发育障碍和精神性疾病中扮演重要角色。因此,调控小胶质细胞表型极化将为治疗某些精神神经疾病提供新的思路。
胞内活性氧簇(ROS)在小胶质细胞表型极化过程中发挥关键作用。例如,抑制线粒体电子传递链提高ROS浓度可促进M1型极化。同时,抑制NADPH氧化酶活性降低ROS浓度可阻止M1型极化。因此,改变胞内ROS水平可能调控小胶质细胞表型极化。课题组构建了直径小于5纳米的氧化铈纳米粒,其表面共存Ce3+和Ce4+两种价态,价态间的相互转换赋予纳米铈同时、高效、持续性消除过氧化氢、超氧阴离子及羟自由基等多种ROS的能力。课题组发现,纳米铈通过消除乏氧条件下过量产生的ROS阻断NF-κB炎性信号通路,抑制促炎细胞因子并促进抑炎细胞因子的产生。同时,小胶质细胞从M1到M2表型逆转降低了乏氧条件下共孵育神经元细胞的死亡,从而产生神经保护效应。这项工作揭示了
ROS在调控小胶质细胞表型极化中的关键作用,为在病理条件下促使免疫微环境再平衡奠定了基础。
复旦大学药学院博士研究生曾峰为论文的第一作者,复旦大学药学院李聪教授为论文的通讯作者。该研究获得国家自然科学基金委和上海市科委重点项目的支持。
(封面制图:张力菲)