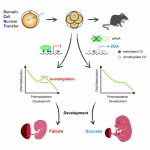
同济大学高绍荣/张勇教授团队在《Cell Stem Cell》发表论文揭示DNA再甲基化导致体细胞克隆胚胎发育异常的表观遗传机制
30.08.2018 00:44
本文来源: 同济大学
8月23日,我校生命科学与技术学院高绍荣教授和张勇教授课题组在国际权威学术期刊《Cell Stem Cell》上在线发表题为“Inhibition of aberrant DNA re-methylation improves post-implantation development of somatic cell nuclear transfer embryos”的文章。该研究通过对不同发育命运体细胞克隆胚胎进行全基因组DNA甲基化组高通量测序分析,详细地研究了小鼠克隆胚胎早期着床前发育过程中DNA甲基化修饰的重编程过程,并揭示了异常的DNA再甲基化(DNA re-methylation)是导致克隆胚胎着床后发育异常的关键因素。这是实验室继2016年在《Cell Discovery》发表论文揭示组蛋白修饰异常导致体细胞核移植效率低下后的又一重要研究成果。
体细胞核移植(somatic cell nuclear transfer, SCNT)是指将供体细胞核经显微操作移入去核的卵母细胞中,组成重构胚胎并使之发育成新个体的技术。在过去的几十年时间里,虽然这项技术在多种动物上获得成功,但核移植胚胎和正常受精胚胎相比,发育率仍然极低。以小鼠为例,克隆动物的出生率只有1%左右;此外,这些成功克隆的胚胎也往往存在着胎儿及胎盘的多种发育异常。此前,研究人员陆续揭示了导致克隆效率低下的多种表观遗传障碍及解决办法,这些研究成果促进了灵长类动物克隆的突破。然而,克隆胚胎中DNA甲基化的重编程过程及其对克隆效率的影响在很大程度上还是未知的。
在这项研究中,研究人员利用微量细胞全基因组亚硫酸氢盐测序(WGBS)技术,首次绘制了不同发育命运的克隆胚胎植入前发育过程中的全基因组DNA甲基化组图谱。研究发现克隆胚胎早期发育过程中CpG位点的DNA甲基化动态变化存在着再甲基化的现象,特别是4细胞时期较为明显。通过对比不同发育命运克隆胚胎与正常受精胚胎在同一发育时期的DNA甲基化差异,研究人员在早期着床前发育各个时期鉴定出了广泛的再甲基化位点(rDMR),并且这一再甲基化现象在发育阻滞的克隆胚胎中更为明显。通过分别以多种终末分化细胞作为供体细胞,研究人员还发现这一再甲基化过程在克隆胚胎发育中是一个广泛存在并且具有供核细胞特异性的机制。结合转录组数据,进一步的分析发现这一再甲基化过程是导致克隆胚胎中合子基因和部分逆转座子不完全激活的关键因素。
更重要的是,通过干扰DNA甲基化酶的表达可以有效降低克隆胚胎中异常的DNA再甲基化机制,重新激活克隆胚胎的特定转录本,并改进克隆胚胎的体内外发育效率。值得一提的是,由此获得的成体克隆,其胎盘发育也得到了明显的改善,这是以往针对多种表观遗传障碍的解决办法都没有做到的,为研究着床后克隆胚胎的异常发育提供了新的思路。
最后,研究人员发现克隆胚胎的异常DNA再甲基化和组蛋白修饰重编程缺陷是两个相对独立的壁垒。同时采取敲除DNA甲基化酶与过表达组蛋白去甲基化酶两种措施,可以使克隆成功率提高到17%左右。
综上所述,这项研究发现遗传自供核细胞的DNA再甲基化记忆是体细胞核移植中一种新的表观遗传障碍,而打破克隆胚胎中的多种表观重编程壁垒能大大提高克隆效率。此外,DNA再甲基化影响克隆胚胎着床后胚外组织发育的相关详细机理值得进一步的详细研究。
同济大学高绍荣教授实验室的高睿博士、张勇教授实验室的王晨飞博士及高亚威副教授为本文的共同第一作者。高绍荣教授、张勇教授及刘文强副研究员为本文的共同通讯作者。本文的其他作者还包括高绍荣教授实验室的陈嘉瑜副教授、技术员寇晓晨和赵艳红、廖雨涵、柏丹丹、乔志斌、杨磊、王明珠、臧茹歌、刘晓雨博士、贾艳平、李延鹤、张亚林、殷吉庆老师、王红老师以及同济大学附属第一妇婴保健院的万小平院长。该研究得到了科技部重点研发计划、国家自然科学基金委、上海市科委和中国博士后科学基金会的支持。
文章正文内容链接:
本文来源: 同济大学
30.08.2018 00:44