复旦大学生命科学学院麻锦彪课题组 在RNA结合蛋白hnRNP A2/B1及m6A识别研究中取得新进展
近日,复旦大学生命科学学院、遗传工程国家重点实验室教授麻锦彪团队在RNA结合蛋白hnRNP A2/B1和N6-腺嘌呤甲基化(m6A)识别研究中取得重要进展,在分子水平阐明了hnRNP A2/B1识别RNA底物的序列特异性与多变性,提出了识别m6A修饰的可能机制,有助于理解hnRNP A2/B1在多种神经退行性疾病中作用机制。1月29日,相关研究成果以《hnRNP A2/B1蛋白识别核糖核苷酸序列特异性与多变性的分子机理》(Molecular basis for the specific and multivariant recognitions of RNA substrates by human hnRNP A2/B1)为题在线发表于《自然·通讯》(Nature Communications)。
人体中的hnRNP A2/B1蛋白是一个在许多生物过程中都起着重要生物学作用的多功能RNA结合蛋白,包括信使RNA(mRNA)的加工,转运以及代谢等过程,并在多种神经退行性疾病中发挥重要作用,是著名物理学家霍金所患的渐冻人症(ALS)的主要元凶之一。hnRNP A2/B1能够通过特异性识别RNA序列参与长非编码RNA的调节以及miRNA分选进入外泌体,同时可能参与到目前快速发展的表观转录组(Epitranscriptome)领域,通过识别初级微小RNA(Pri-miRNA)上的m6A修饰,促进微处理器(microprocessor)复合体DROSHA/DGCR8对pri-miRNA的加工。
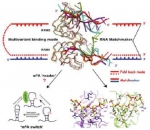
课题组通过X-射线晶体学方法和生物化学等手段解析了hnRNP A2/B1蛋白与多种RNA序列底物的复合物的高分辨率晶体结构,从分子水平阐释了hnRNP A2/B1蛋白的RRM1识别AGG和RRM2识别UAG的底物结合特异性和多样性的结构基础。结合生物信息学分析,该研究提出hnRNP A2/B1蛋白可能是通过m6A 开关(m6A switch)改变底物构象的机制间接识别m6A修饰,而不是直接识别。
复旦大学生命科学学院和遗传工程国家重点实验室为该工作的第一完成单位,复旦大学生命科学学院生物化学系博士研究生吴柏星、苏世晨为本文并列第一作者。复旦大学生命科学学院、遗传工程国家重点实验室麻锦彪教授主持该项研究工作,康奈尔大学威尔康奈尔医学院塞米.贾弗里(Samie R. Jaffrey)课题组参与了m6A相关的高通量测序数据的生物信息分析与比较工作,复旦大学生命科学学院生物物理系甘建华教授研究团队参与了蛋白质-核酸复合物晶体数据收集以及核酸分离纯化工作。研究工作得到国家自然科学基金、中组部千人计划、遗传工程国家重点实验室的经费支持。
(论文链接: https://www.nature.com/articles/s41467-017-02770-z )
hnRNP A2/B1识别RNA底物的序列特异性和多样性及其识别m6A修饰的m6A 开关机制
(封面制图:方圆)