生物医学研究院细胞与分子生物学实验室 揭示代谢对肿瘤化疗敏感性调控的新机制
代谢改变是癌症的一个重要特征,肿瘤细胞通过上调糖酵解途径产生更多重要的中间代谢物,用于合成肿瘤细胞快速增殖所需的多种生物大分子。此外,研究发现糖酵解通路的激活也能保护肿瘤细胞逃避DNA损伤信号引发的细胞死亡,然而具体机制仍未阐明。
2月6日,复旦大学生物医学研究院细胞与分子生物学实验室在《自然·通讯》(Nature Communications)杂志在线发表题为《乙酰化调控的PFKFB3胞浆定位转换促进糖酵解并保护细胞免于顺铂化疗诱导的凋亡过程》(“Acetylation accumulates PFKFB3 in cytoplasm to promote glycolysis and protects cells from cisplatin-induced apoptosis”)的科研论文。该论文报道了代谢酶PFKFB3的乙酰化修饰对糖酵解和肿瘤化疗敏感性的重要调控作用。
6-磷酸果糖激酶-2/2,6-二磷酸果糖磷酸酶3(PFKFB3)催化代谢小分子果糖-2,6-二磷酸(F2,6BP)的合成和水解,后者是糖酵解通路的强效激活剂。在PFKFB蛋白家族的4个成员中,PFKFB3是唯一一种定位在细胞核内的蛋白,然而其原因并不清楚。
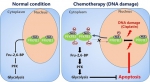
该研究发现引发DNA损伤的化疗药物顺铂能促进糖酵解水平,而该过程可被PFKFB3基因敲除所抑制。对具体机制的研究表明PFKFB3蛋白第472位赖氨酸残基(K472)可被乙酰化修饰,该修饰使PFKFB3的核定位信号失活,促使PFKFB3在细胞浆中的滞留。而定位于细胞浆中的PFKFB3更易于被激酶AMPK磷酸化,导致PFKFB3的激活并且促进糖酵解,从而保护细胞免于凋亡。此外,多种引发DNA损伤的条件如顺铂处理可显著提高PFKFB3的K472位点乙酰化水平,表明DNA损伤是诱导该过程的关键生理信号。在这些研究的基础上,联合使用小分子化合物抑制PFKFB3可以显著增强顺铂对裸鼠移植瘤生长的抑制作用。
该研究不仅揭示了代谢调节酶PFKFB3的活性受乙酰化修饰调控的新机制,也提示通过靶向抑制PFKFB3而提高顺铂等化疗药物的敏感性有可能成为临床上一个新的治疗策略。
论文的通讯作者为复旦大学生物医学研究院和附属上海市第五人民医院双聘PI袁海心青年研究员,第一作者为复旦大学博士研究生李甫隆,此外,刘锦频和包若萱等博士研究生亦参与了部分工作。该研究受到了国家科技重大专项和国家自然科学基金经费的支持。
DNA损伤信号通过乙酰化并激活PFKFB3,从而提高糖酵解水平是肿瘤细胞抵抗化疗作用的重要机制之一。