生命科学学院鲁伯埙教授课题组合作研究发现 治疗亨廷顿病的小分子药物候选物
近日,复旦大学生命科学学院鲁伯埙教授课题组与中国科学院药物所谢欣研究员、胡有洪研究员等合作发现GPR52的小分子拮抗剂对神经退行性病变亨廷顿病的潜在治疗作用。相关研究成果以《靶向Gpr52可降低突变型HTT水平并拯救亨廷顿舞蹈病相关表型》(Targeting Gpr52 lowers
mutant HTT levels and rescues Huntington’s disease-associated phenotypes)为题,于3月
28日在线发表于《大脑》( Brain )。
亨廷顿病(HD)与阿尔茨海默病(AD)、帕金森氏病(PD)和肌萎缩侧索硬化(ALS)并称四大神经退行性疾病,又称神经变性病(Neurodegenerative Disorders)。此类疾病随着时间推移而恶化,导致神经元退行变性、死亡,严重影响中、老年人健康,造成巨大的社会和家庭负担,目前没有任何根本性治疗手段。其中,HD是最主要的单基因遗传病,影响全球近万分之一的人口,并且有几倍于此的人群由于携带致病基因将会在中老年发病。由于其遗传图景清晰,是神经变性病中重要的模式疾病。遗传学证据表明,亨廷顿病主要由突变基因HTT所表达的突变HTT蛋白的神经毒性所导致,因此降低HTT蛋白水平是治疗HD的极具前景的治疗方法。
复旦大学生命科学学院鲁伯埙课题组自2012年起向这一目标发起挑战,完成了一系列突破。在2013年发表的工作中,课题组及合作者证明了降低可溶性的mHTT水平可显著拯救人类干细胞分化的亨廷顿病神经元模型的神经元死亡表型(FASEB Journal 2013)。为了进一步寻找降低mHTT水平的药靶,课题组及合作者展开了一系列遗传学筛选,获得了一系列可以调控mHTT蛋白水平从而拯救HD的潜在药靶基因(Nature Neuroscience 2013,Trends in Pharmacological Sciences 2014,eLife 2015,Cell Research 2017,Autophagy 2017,Cell Systems 2018等),并且揭示了mHTT蛋白导致疾病的可能的根本性机制(Nature Chemical Biology 2017, Autophagy 2017等)。
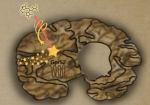
在发现的潜在药靶基因中,GPR52是一个G蛋白偶联受体,并富集于疾病影响最严重的纹状体脑区。G蛋白偶联受体位于细胞膜上,且其内源活性天然地受小分子影响,因此适合于药物研发。在美国药监局FDA已批准的药物中,以G蛋白偶联受体为靶点的药物的比例最高。因此,GPR52可能是HD最具制药潜力的靶点之一。课题组在人类干细胞分化神经元、小鼠培养神经元、果蝇动物模型及小鼠模型中验证了GPR52对mHTT蛋白水平的作用,证实了小鼠在体敲除Gpr52基因可以显著拯救HD的相关表型,从而从整体动物表型层面验证了Gpr52作为HD药靶的潜力。
图1. 靶向Gpr52可降低突变型HTT水平并拯救亨廷顿舞蹈病相关表型
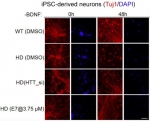
由于此前关于Gpr52特异性拮抗剂没有任何相关报道,鲁伯埙课题组与中科院药物所谢欣及胡有洪课题组合作,采用高通量筛选方法,获得了特异性阻断Gpr52下游通路的小分子先导化合物E7,并进一步在细胞、果蝇及小鼠模型上验证了E7的确可以有效降低纹状体的mHTT水平,并有效拯救了HD相关表型,特别是病人诱导干细胞分化神经元的死亡以及HD小鼠的运动能力退化均得到显著修复,有力证明了靶向Gpr52的小分子药物对疾病的潜在治疗作用,为从根本上治疗HD的小分子化合物新药的发现提供了可能。
图2. 新型Gpr52拮抗剂E7拯救了亨廷顿疾病细胞模型相关表型
据悉,目前该研究发现已申请发明专利,引起了国际药企Heptares等的关注,并进入签署合作协议阶段。国际著名神经科学家斯坦福大学教授Aaron Gitler为该成果撰写了专文评述。复旦大学生命科学学院鲁伯埙教授课题组博士研究生宋海坤为该文的第一作者,复旦大学生命科学学院鲁伯埙教授和中国科学院药物所谢欣研究员为共同通讯作者。本研究受到了国家重点研发计划,国家自然科学基金委及复旦大学-药物所联合创新基金的资助。